CIRCULAR EXTERNA 2025151000000009-5 DE 2025
(agosto 11)
Diario Oficial No. 53.209 de 11 de agosto de 2025
SUPERINTENDENCIA NACIONAL DE SALUD
| PARA: | GESTORES FARMACÉUTICOS |
DE: | SUPERINTENDENCIA NACIONAL DE SALUD |
ASUNTO: | POR LA CUAL SE IMPARTEN INSTRUCCIONES ADICIONALES A LA CIRCULAR EXTERNA 047 DE 2007, PARA EL REPORTE DE INFORMACIÓN DE LOS GESTORES FARMACÉUTICOS PARA EFECTOS DE SUPERVISIÓN. |
FECHA: | 11-08-2025 |
La Ley 1122 de 2007, en el artículo 36 creó el Sistema de Inspección, Vigilancia y Control del Sistema General de Seguridad Social en Salud, en cabeza de la Superintendencia Nacional de Salud de acuerdo con sus competencias constitucionales y legales.
Que, en el artículo 37 de la precitada ley estableció los ejes del Sistema de Inspección, Vigilancia y Control de la Superintendencia Nacional de Salud, entre otros, el eje de Información consistente en "Vigilar que los actores del Sistema garanticen la producción de los datos con calidad, cobertura, pertinencia, oportunidad, fluidez y transparencia".
Que, la Ley Estatutaria 1751 de 2015, reguló el derecho fundamental a la salud, consagrándolo como un derecho autónomo e irrenunciable en sus dimensiones individual y colectiva, comprendiendo el acceso a los servicios de salud de manera oportuna, eficaz y con calidad para la preservación, el mejoramiento y la promoción de la salud.
Que, en el artículo 6o de la precitada ley establece como elementos esenciales e interrelacionados del derecho a la salud la disponibilidad, accesibilidad, calidad e idoneidad profesional, continuidad, oportunidad, eficiencia, entre otros, tanto para los servicios y tecnologías de salud.
Que, en el artículo 8o de la precitada ley estableció que los servicios y las tecnologías de salud deberán ser suministrados de manera completa para prevenir, paliar o curar la enfermedad, con independencia del origen de la enfermedad o condición de salud, del sistema de provisión, cubrimiento o financiación definido por el legislador. Adicionalmente indicó la prohibición de fragmentar la responsabilidad en la prestación de un servicio de salud específico en desmedro de la salud del usuario.
Que, la Ley 1955 de 2019, en su artículo 243, adicionó el numeral 8 al artículo 155 de la Ley 100 de 1993, el cual incluyó a los Operadores Logísticos de Tecnologías en Salud y a los Gestores Farmacéuticos, como integrantes del Sistema General de Seguridad Social en Salud. Así mismo, estableció la responsabilidad del Ministerio de Salud y Protección Social respecto a la reglamentación de los requisitos financieros y de operación de estos agentes.
Que, la Ley 1966 de 2019, adoptó medidas para la gestión y transparencia en el Sistema de Seguridad Social en Salud, con lo cual, en su artículo 2o, creó el Sistema Integrado de Control, Inspección y Vigilancia para el Sector Salud, bajo la dirección de la Superintendencia Nacional de Salud, estableciendo adicionalmente para el caso de la Superintendencia Financiera la posibilidad de servir de asesor técnico, brindar capacitación, emitir conceptos, transferencia de conocimiento, y mejores prácticas para el fortalecimiento de la inspección, vigilancia y control sobre operadores logísticos de tecnologías en salud y gestores farmacéuticos, en lo que corresponde a las condiciones financieras y a las buenas prácticas de gobierno corporativo que deben cumplir estas entidades.
Que, en parágrafo 1 del artículo 2o de la precitada ley indicó que "se entiende por gestores farmacéuticos los operadores logísticos, cadenas de droguerías, cajas de compensación y/o establecimientos de comercio, entre otros, cuando realicen la dispensación ambulatoria en establecimientos farmacéuticos a los afiliados del Sistema General de Seguridad Social en Salud por encargo contractual de las EPS, IPS y de otros actores del sistema".
Que, para el efecto de interpretación de esta definición, se debe entender la dispensación de medicamentos y dispositivos médicos de conformidad con el artículo 2.5.3.10.3 del Decreto número 780 de 2016, de forma ambulatoria, según lo establecido en el parágrafo 1, artículo 2o Ley 1966 de 2019, en establecimiento farmacéutico según lo definido en el artículo 2.5.3.10.3 del Decreto número 780 de 2016, a los afiliados del Sistema General de Seguridad Social en Salud según el artículo 2.1.1.3 del Decreto número 780 de 2016 y por encargo contractual (acuerdo de voluntades) según los lineamientos establecidos en el Decreto número 441 de 2022.
Que, el Decreto número 1080 de 2021, modificó la estructura de la Superintendencia Nacional de Salud y en su artículo 4o, estableció sus funciones, que entre otras, el numeral 11 indicó la función de propender que los actores del Sistema General de Seguridad Social en Salud "suministren la información con calidad, cobertura, pertinencia, oportunidad, fluidez y transparencia" y el 20 el ejercicio de "inspección, vigilancia y control del servicio farmacéutico, sin perjuicio de las competencias atribuidas a otras autoridades", entendiendo el servicio farmacéutico como "el servicio de atención en salud responsable de las actividades, procedimientos e intervenciones de carácter técnico, científico y administrativo, relacionados con los medicamentos y los dispositivos médicos utilizados en la promoción de la salud y la prevención, diagnóstico, tratamiento y rehabilitación de la enfermedad, con el fin de contribuir en forma armónica e integral al mejoramiento de la calidad de vida individual y colectiva", de conformidad con el artículo 2.5.3.10.4 del Decreto número 780 de 2016.
Que, el artículo 31 del precitado decreto, estableció entre otras funciones para la Superintendencia Delegada para Operadores Logísticos de Tecnologías en Salud y Gestores Farmacéuticos, la de "adelantar acciones de supervisión a los operadores logísticos de tecnologías en salud y gestores farmacéuticos, en relación con el almacenamiento, distribución, comercialización, entrega y seguimiento de medicamentos y dispositivos médicos…", así como la de "ejercer inspección y vigilancia sobre el cumplimiento de los derechos de los usuarios en el Sistema General de Seguridad Social en Salud, en lo que compete a las acciones adelantadas por los operadores logísticos de tecnologías en salud y gestores farmacéuticos" y "Ejercer inspección y vigilancia para que los sujetos vigilados cuenten con sistemas de información y suministren la información con calidad, cobertura, pertinencia, oportunidad, fluidez y transparencia".
Que, el Decreto número 441 de 2022 sustituyó el Capítulo 4 del Título 3 de la Parte 5 del Libro 2 del Decreto número 780 de 2016 que tiene por objeto regular algunos aspectos generales de los acuerdos de voluntades entre las entidades responsables de pago y los prestadores de servicios de salud o proveedores de tecnologías en salud, celebrados entre dos o más personas naturales o jurídicas para la prestación o provisión de servicios y tecnologías en salud, en sus etapas precontractual, contractual y post contractual, y establece mecanismos de protección a los usuarios, siendo de aplicación dichas disposiciones a las entidades responsables de pago, los prestadores de servicios de salud y los proveedores de tecnologías en salud; así como a las entidades que administran u operan los regímenes Especial y de Excepción y al Fondo Nacional de Salud de las Personas Privadas de la Libertad, cuando celebren acuerdos de voluntades con los prestadores de servicios de salud o con proveedores de tecnologías en salud.
Que de conformidad con el numeral 8 del artículo 2.5.3.4.1.3 Definiciones, del Decreto número 780 de 2016 se considera por Proveedores de Tecnologías en Salud (PTS) "(…) toda persona natural o jurídica que realice la disposición, almacenamiento, venta o entrega de tecnologías en salud, incluyendo a los operadores logísticos de tecnologías en salud, gestores farmacéuticos, organizaciones no gubernamentales, universidades y otras entidades privadas que realicen estas actividades".
Que se hace necesario emitir instrucciones a los Gestores Farmacéuticos para el reporte de información a la Superintendencia Nacional de Salud – Superintendencia Delegada para Operadores Logísticos de Tecnologías en Salud y Gestores Farmacéuticos, para efectos de labores de Inspección, Vigilancia y Control a estos, de la siguiente manera:
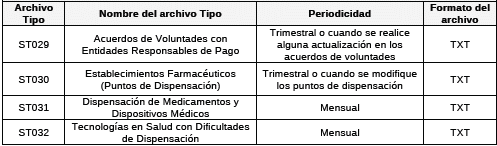
PRIMERA. Adiciónese al Capítulo denominado Gestores Farmacéuticos y Operadores Logísticos de Tecnologías en Salud del Título XI – Anexos Técnicos de la Circular Única 047 de 2007, los siguientes archivos:
SEGUNDA. Para efectos de reportar la información señalada en la presente circular, los gestores farmacéuticos deberán reportar los archivos tipo en la plataforma nRVCC, cumpliento con las siguientes especificaciones técnicas para el cargue de la información:
a) Nombre del archivo: NITDVPPANNOFFFFF.EXT, las sintaxis que componen el nombre del archivo deben estar unidas, sin caracteres de separación y, en el orden mencionado, donde:
NIT: Número de identificación tributaria de la entidad que reporta
DV: Dígito de verificación
PP: Periodo de corte de la información reportada
ANNO: Año de orte de la información reportada
FFFFF: Número del archivo
EXT: Extensión del archivo (TXT)
b) Los archivos deben ser reportados en formato TXT, separado por Pipeline (|).
c) Los Archivos Tipo deben ser remitidos con firma digital del Representante Legal.
d) Toda la información debe seguir los principios de transparencia, integralidad y veracidad, por tal razón no podrá contener información sesgada, insuficiente, no verificable, o cualquier otra que pueda inducir a error o confusión, o que no permita a la Superintendencia hacerse un juicio fundado y objetivo sobre los vigilados.
TERCERA. Los Gestores Farmacéuticos deberán reportar de forma trimestral a esta Superintendencia el Archivo Tipo ST029-Acuerdos de Voluntades con Entidades Responsables de Pago. La información que se debe reportar en este formato son los acuerdos de voluntades con las Entidades Responsables de Pago que hayan estado vigentes en el periodo de reporte. El primer reporte del formato ST029 corresponde a los acuerdos de voluntades vigentes en el periodo de 1 de julio a 30 de septiembre de 2025, con fecha máxima de reporte el 20 de octubre de 2025.
En caso de presentarse cambios en los acuerdos de voluntades antes de la fecha de corte, las entidades deberán realizar el reporte dentro de los 20 días del siguiente mes al que ocurrió el ajuste.
CUARTA. Los Gestores Farmacéuticos deberán reportar de forma trimestral a esta Superintendencia el Archivo Tipo ST030-Establecimientos Farmacéuticos (Puntos de Dispensación). La información que se debe reportar en este formato son los puntos de dispensación de los acuerdos de voluntades con las Entidades Responsables de Pago informados en el formato ST029. El primer reporte del formato ST030 deberá corresponder a los establecimientos farmacéuticos vigentes entre el 1 de julio al 30 de septiembre de 2025, con fecha máxima de reporte el 20 de octubre de 2025.
PARÁGRAFO 1o. En caso de presentarse cambios en los puntos de dispensación antes de la fecha de corte, las entidades deberán realizar el reporte dentro de los 20 días del siguiente mes al que ocurrió el ajuste.
QUINTA. Los Gestores Farmacéuticos deberán reportar de forma mensual a esta Superintendencia el Archivo Tipo ST031-Dispensación de Medicamentos y Dispositivos Médicos. La información que se debe reportar en este formato es el detalle de la dispensación ambulatoria de las fórmulas de medicamentos y dispositivos médicos. El primer reporte del formato ST031 deberá corresponder a la dispensación de medicamentos y dispositivos médicos entre el 1 al 30 de septiembre de 2025, con fecha máxima de reporte el 20 de octubre de 2025.
SEXTA. Los Gestores Farmacéuticos deberán reportar de forma mensual a esta Superintendencia el Archivo Tipo ST032-Tecnologías en Salud con Dificultades de Dispensación. La información que se debe reportar en este formato corresponde con aquellas tecnologías en salud prescritas a los usuarios y que no pueden ser entregados de manera oportuna, completa, eficiente y con calidad, por encontrarse inmersos en alguna de las siguientes situaciones: aumento inesperado de la demanda, disminución de la oferta, aumento de precios, problemas logísticos, entrega incompleta por parte del proveedor, producto sin registro sanitario vigente, retiro del mercado problemas de calidad / alerta sanitaria, bloqueo del proveedor por cartera u otra que sustente la dificultad. El primer reporte del formato ST032 deberá corresponder a las tecnologías con dificultades de dispensación registradas entre el 1 al 30 de septiembre de 2025, con fecha máxima de reporte el 20 de octubre de 2025.
SÉPTIMA. Los Gestores Farmacéuticos deberán reportar la información de datos generales que requiere ser reportada de manera obligatoria, veraz, completa, con calidad y oportunidad por cada entidad vigilada, en la plataforma nRVCC en el módulo de datos generales, en la información adicional del vigilado para lo correspondiente a sedes, consorcios y uniones temporales y centros de distribución.
La veracidad y completitud de la información consignada en el módulo de Datos Generales es una responsabilidad indelegable del/la Representante Legal. Así, el/la Representante Legal, no solo asume el papel fundamental de garantizar la integridad de los datos, sino que también, contrae la responsabilidad exclusiva tanto de la inclusión inicial, como de cualquier ajuste o actualización requerida en dicho módulo.
Toda la información solicitada deberá ser diligenciada y mantenerse actualizada, por parte de las entidades sometidas a inspección, vigilancia y control de la Superintendencia Nacional de Salud ante cambios en la información registrada en el Sistema de recepción y validación de archivos nRVCC, en el siguiente enlace https://nrvcc.supersalud.gov.co/ o en el sitio que esta Superintendencia disponga para ello.
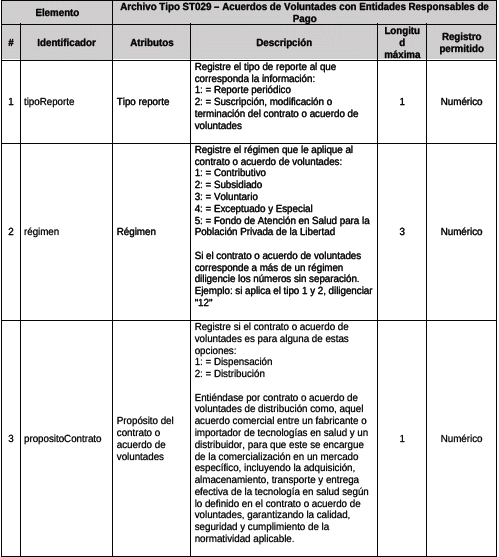
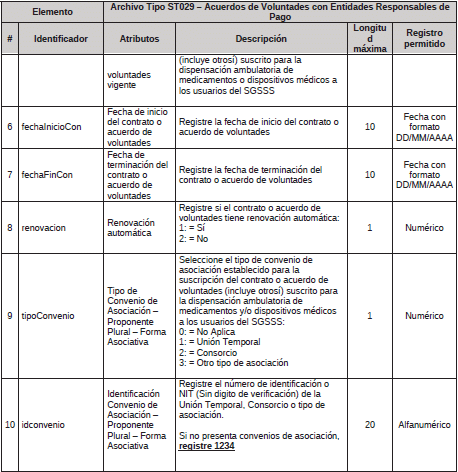
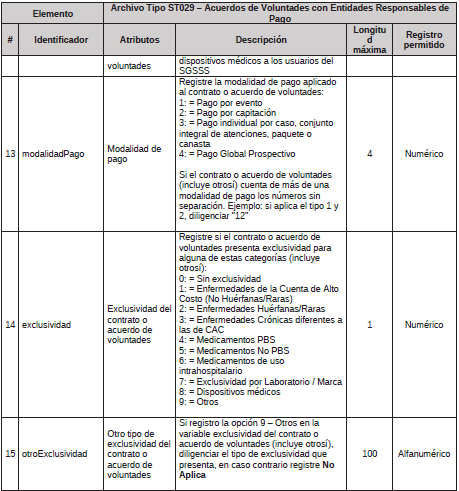
1. Archivo Tipo ST029 – Acuerdos de Voluntades con Entidades Responsables de Pago
ARCHIVO TIPO ST029
Acuerdos de Voluntades con Entidades Responsables de Pago
TIPO DE ENTIDAD A LA QUE APLICA: Gestores Farmacéuticos.
PERIODICIDAD: Trimestral o cuando el Gestor Farmacéutico realice alguna actualización en su contratación.
FECHA DE CORTE: marzo 31, junio 30, septiembre 30, diciembre 31
FECHA DEL REPORTE: abril 20, julio 20, octubre 20, enero 20 o cuando se realice actualización de los acuerdos de voluntades, dentro de los 20 días del siguiente mes al que ocurrió el ajuste.




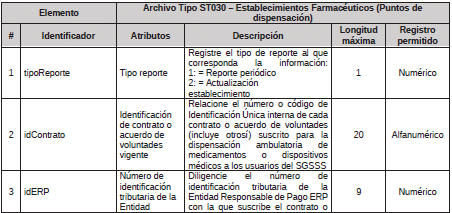
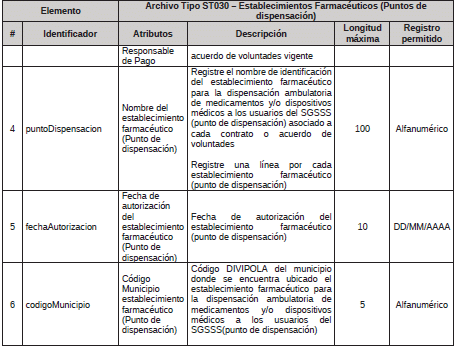
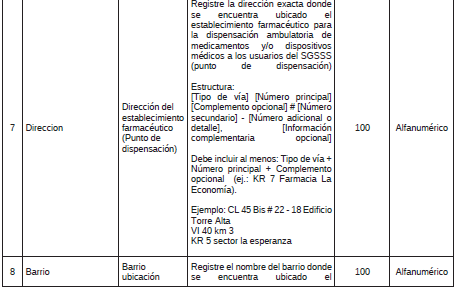
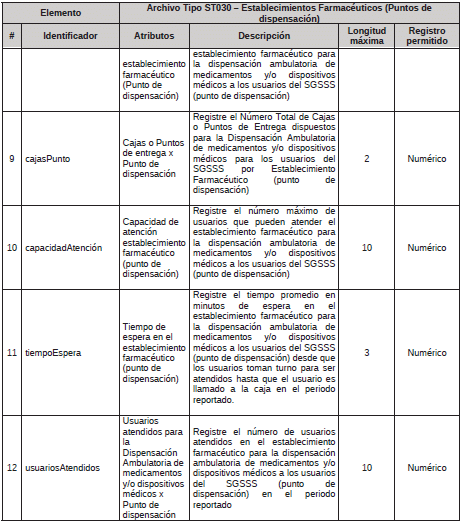
2. Archivo Tipo ST030 - Establecimientos Farmacéuticos (Puntos de dispensación)
ARCHIVO TIPO ST030
Establecimientos Farmacéuticos (Puntos de dispensación)
TIPO DE ENTIDAD A LA QUE APLICA: Gestores Farmacéuticos.
PERIODICIDAD: Trimestral o cuando el Gestor Farmacéutico realice alguna actualización en su contratación.
FECHA DE CORTE: marzo 31, junio 30, septiembre 30, diciembre 31
FECHA DEL REPORTE: abril 20, julio 20, octubre 20, enero 20 o cuando se realice actualización de los acuerdos de voluntades, dentro de los 20 días del siguiente mes al que ocurrió el ajuste.
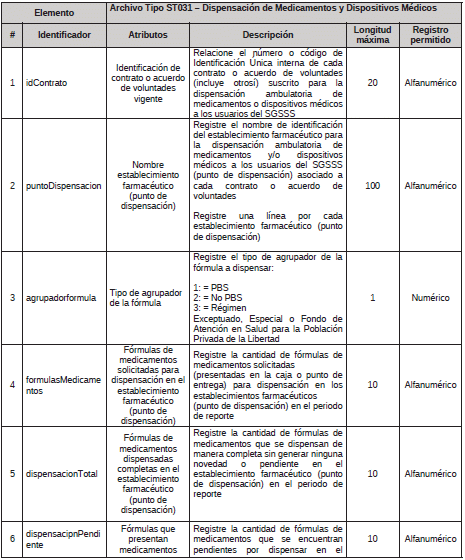
3. Archivo Tipo ST031 - Dispensación de Medicamentos y Dispositivos Médicos
ARCHIVO TIPO ST031
Dispensación de Medicamentos y Dispositivos Médicos
TIPO DE ENTIDAD A LA QUE APLICA: Gestores Farmacéuticos.
PERIODICIDAD: Mensual
FECHA DE CORTE: Último día calendario de cada mes
FECHA DEL REPORTE: Veinte (20) primeros días calendario después de la fecha de corte

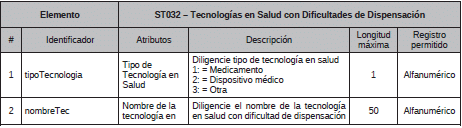
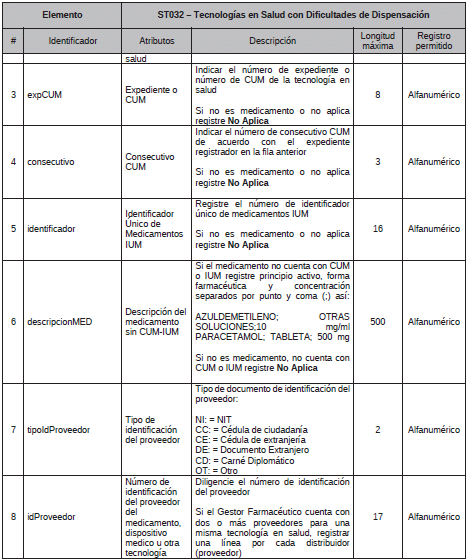
4. Archivo Tipo ST032 - Tecnologías en Salud con Dificultades de Dispensación
ARCHIVO TIPO ST032
Tecnologías en Salud con Dificultades de Dispensación.
TIPO DE ENTIDAD A LA QUE APLICA: Gestores Farmacéuticos.
PERIODICIDAD: Mensual
FECHA DE CORTE: Último día calendario de cada mes
FECHA DEL REPORTE: Veinte (20) primeros días calendario después de la fecha de corte


IV. SEGURIDAD DE LA INFORMACIÓN.
Los Gestores Farmacéuticos garantizarán la protección de la información a fin de asegurar la confidencialidad, integridad y disponibilidad de todos los datos que maneja, tanto en los sistemas internos como con los terceros involucrados asegurándose de que también cumplan con los mismos estándares de seguridad y privacidad, incluyendo cláusulas de confidencialidad y protección de datos a todo nivel; implementando medidas de seguridad para prevenir la suplantación, alteración, extracción, secuestro y cualquier acceso no autorizado a los datos. Esto incluye el uso de contraseñas seguras, cifrado de información sensible y la gestión de permisos de acceso.
A fin de garantizar también la calidad, cobertura, oportunidad, pertinencia, fluidez, transparencia, veracidad, integridad, custodia y disponibilidad de los datos; de acuerdo con lo establecido en la normativa vigente expedida por el Archivo General de la Nación, la Superintendencia de Industria y Comercio y el Ministerio de Tecnologías de Información y Comunicaciones, de conformidad con la Ley 527 de 1999, la Ley Estatutaria 1581 de 2012, el Decreto número 1377 de 2013 la Ley 594 de 2000, la Ley 2015 de 2020 y las normas que las modifiquen o sustituyan.
De conformidad con lo establecido en el artículo 130 de la Ley 1438 de 2011, modificado por el artículo 3o de la Ley 1949 de 2019, la inobservancia e incumplimiento de las instrucciones impartidas en esta circular externa, dará lugar a la configuración de una infracción administrativa y su respectiva sanción por parte de la Superintendencia Nacional de Salud, previo agotamiento del debido proceso administrativo que corresponda, sin perjuicio de las demás responsabilidades disciplinarias, fiscales, penales o civiles que puedan derivarse y las sanciones que puedan imponer otras autoridades judiciales y/o administrativas.
La presente Circular Externa rige a partir de la fecha de su publicación en el Diario Oficial, adiciona en lo pertinente la Circular Externa 047 de 2007.
Dada en Bogotá, D. C., a 11 de agosto de 2025.
El Superintendente Nacional de Salud,
Helver Giovanny Rubiano García








